Questão 1
Um químico descobriu que o níquel metálico pode ceder elétrons espontaneamente em soluções de NiCl2, e construiu a seguinte pilha: Ni°|Cu2+ || Ni2+|Cu° Para esta pilha, é correto afirmar:
a) o Ni° oxida e o Cu2+ reduz.
b) o químico transformou cobre em níquel.
c) o cátodo é o Ni2+ e o ânodo é o Ni°.
d) a solução de Cu2+ ficará mais concentrada.
e) a solução de Ni2+ ficará menos concentrada.
Questão 2
Considere as seguintes afirmações a respeito da pilha de Daniell:
I. No ânodo ocorre redução dos íons da solução.
II. A passagem de elétrons, no circuito externo, ocorre sempre do cátodo em direção ao ânodo.
III. O cátodo sofre uma redução de massa.
Marque a alternativa que indica os itens que são corretos:
a) I e II.
b) II e III.
c) I e III.
d) todas.
e) nenhuma.
Questão 3
(CESGRANRIO-RJ) Considere a pilha representada abaixo.
Cu(s)/ Cu2+ || Fe3+, Fe2+ / Pt(s)
Assinale a afirmativa falsa.
a) A reação de redução que ocorre na pilha é: Cu2+ + 2 e– → Cu(s)
b) O eletrodo de cobre é o ânodo.
c) A semi-reação que ocorre no cátodo é Fe3+ + e– → Fe2+.
d) A reação total da pilha é: 2 Fe3+ + Cu → 2 Fe2+ + Cu2+
e) Os elétrons migram do eletrodo de cobre para o eletrodo de platina
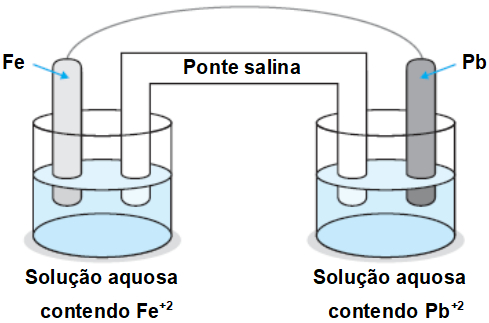
Questão 4
(UNIFESP-SP) Ferro metálico reage espontaneamente com íons Pb2+, em solução aquosa. Esta reação é representada por:
Fe + Pb2+ → Fe2+ + Pb
Na pilha representada pela figura
Em que ocorre aquela reação global,
a) os cátions devem migrar para o eletrodo de ferro.
b) ocorre deposição de chumbo metálico sobre o eletrodo de ferro.
c) ocorre diminuição da massa do eletrodo de ferro.
d) os elétrons migram através da ponte salina do ferro para o chumbo.
e) o eletrodo de chumbo atua como ânodo.
Resposta Questão 1
Letra a). O enunciado fornece a notação de uma pilha, utilizada mundialmente:
Ni°|Ni2+ || Cu2+|Cu°
Na qual os componentes à esquerda da barra dupla (II) indicam a espécie que oxidou (no caso o níquel-Ni) e os da direita, indicam a espécie que reduziu (Cu2+, Cu):
a- Verdadeiro, pois o níquel neutro (Nio) oxida e o cátion cobre (Cu2+) reduz;
b- Falso, pois o químico está formando cobre metálico (durante a redução) e cátion níquel (durante a oxidação);
c- Falso, porque quem oxida é o níquel (Ni), logo ele é o ânodo, enquanto que quem reduz é a espécie Ni+2, logo o níquel (Ni) é o cátodo;
d- Falso, porque os cátions Cu+2 , presentes na solução, serão deslocados para o eletrodo, tornando-a mais diluída;
e- Falso, porque com a oxidação do eletrodo de níquel, cátions Ni+2 serão adicionados na solução, tornando-a mais concentrada.
Resposta Questão 2
Letra e). A resposta é a alternativa porque:
I- Falso, porque no ânodo de uma pilha ocorre a oxidação (perda de elétrons) de uma espécie metálica;
II- Falso, porque no circuito externo de uma pilha de Daniell os elétrons sempre fluem do ânodo em direção ao cátodo;
III- No cátodo de uma pilha de Daniel ocorre a redução (ganho elétrons) do cátion (espécie deficiente em elétrons) presente em sua solução. Ao receber elétrons, o cátion torna-se uma espécie neutra, aderindo ao eletrodo, aumentando sua massa.
Resposta Questão 3
Letra a). O enunciado fornece a notação de uma pilha, utilizada mundialmente:
Cu(s)/ Cu2+ || Fe3+, Fe2+ / Pt(s)
Na qual os componentes à esquerda da barra dupla (II) indicam a espécie que oxidou (no caso o cobre-Cu), enquanto que os da direita indicam a espécie que reduziu (Fe3+, Fe2+):
a- Falso, pois o cobre é a espécie que sofre oxidação, representada pela seguinte equação: Cu(s) → Cu2+ + 2 e–;
b- Verdadeiro, pois o cobre sofre oxidação, e o eletrodo que sofre oxidação é sempre o ânodo;
c- Verdadeiro, pois redução (que sempre ocorre no cátodo) é o ato de ganhar elétron, e quando o cátion Fe+3 ganha um elétron, ele se torna o cátion Fe+2;
d- Verdadeiro, pois o cobre neutro (Cu) está à esquerda da seta juntamente com o cátion Fe+3, e o cátion cobre (Cu+2) e o cátion Fe+2 estão do lado direito da seta, fato este que respeita os componentes que estão oxidando e reduzindo no processo indicado;
e- Verdadeiro, pois os elétrons sempre migram do eletrodo que oxida (Cu) para o eletrodo que reduz (Pt).
Resposta Questão 4
Letra c). Analisando a equação eletroquímica fornecida pelo enunciado:
Fe + Pb2+ → Fe2+ + Pb
Temos o ferro neutro (Fe) no reagente e o cátion ferro II (Fe+2) no produto, fato este que indica a oxidação do ferro. Além disso, temos no reagente o cátion chumbo II (Pb+2) e o chumbo neutro (Pb) no produto, fato este que indica a redução do cátion chumbo. Assim:
a) Falso, como os cátions chumbo II estão sofrendo redução, eles migram para o eletrodo de chumbo;
b) Falso, porque o chumbo metálico, formado a partir da redução do cátion chumbo II, é depositado no eletrodo de chumbo
c) Verdadeiro, porque o ferro metálico está sofrendo oxidação, formando o cátion ferro II que é dissolvido na água;
d) Falso, porque os elétrons migram através do fio condutor externo, do eletrodo de ferro para o eletrodo de chumbo.
e) Falso, porque o eletrodo de chumbo atua como cátodo, pelo fato do chumbo II, presente na solução, estar sofrendo redução.