Questão 1
Um estudante de química, ao entrar no laboratório de química geral, encontrou três frascos contendo três misturas binárias, conforme descrito a seguir.
I- mistura: heterogênea, formada por dois sólidos.
II- mistura: heterogênea, formada por dois líquidos.
III- mistura: homogênea, formada por dois líquidos cujos pontos de ebulição diferem em 80 °C.
A partir dessas características fornecidas, qual ou quais das misturas poderiam ser separadas iniciando pelo método da dissolução fracionada?
a) apenas I.
b) apenas II.
c) apenas III.
d) I e II.
e) I e III.
Questão 2
O cloreto de sódio cristalizado é utilizado na indústria como matéria-prima para produção de diversos produtos químicos, como a soda cáustica e o gás hidrogênio. Porém, o cloreto de sódio é obtido inicialmente na forma de sal grosso, a partir da evaporação da água do mar. Utilizando essas informações, qual das alternativas abaixo inicia melhor a sequência de métodos necessários para a obtenção do sal grosso, livre de impurezas?
a) Catação, dissolução em etanol e decantação.
b) Filtração, destilação e dissolução em água.
c) Sublimação, dissolução em água e peneiração.
d) Dissolução em água, filtração simples e evaporação.
e) Dissolução em etanol, destilação e sublimação.
Questão 3
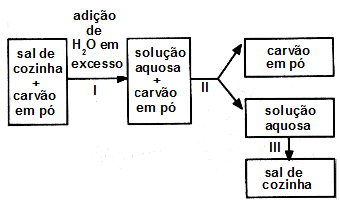
(Uefs-BA) Para separar os componentes do sistema formado por sal de cozinha e carvão em pó, um estudante realiza os tratamentos I, II e, III de acordo com o seguinte esquema:
Em I, ocorre:
a) dissolução do sal de cozinha.
b) ionização do carvão em pó.
c) liquefação do sal de cozinha.
d) liquefação do carvão em pó.
e) sublimação do sal de cozinha.
Questão 4
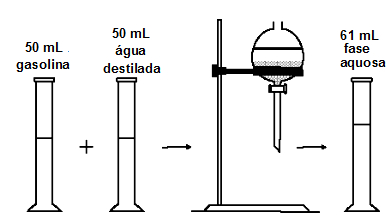
(UFScar - SP) A figura representa o esquema de um experimento para determinação do teor de álcool na gasolina.
Com base no experimento e considerando que não há variação de volume, pode-se afirmar que o teor de álcool, em volume, na gasolina analisada e o processo de extração utilizado são, respectivamente,
a) 11% e dissolução fracionada.
b) 22% e dissolução fracionada.
c) 11% e decantação fracionada.
d) 22% e decantação fracionada.
e) 11% e destilação fracionada.
Resposta Questão 1
Letra a). A única mistura que poderia ser separada utilizando o método da dissolução fracionada é a mistura I. As outras estão incorretas porque:
II- Como a mistura é heterogênea formada por dois líquidos, pode ser facilmente separada utilizando-se um funil de separação.
III- Como a mistura é homogênea formada por dois líquidos, de pontos de ebulições diferentes, deve ser separada usando-se o método da destilação fracionada.
Resposta Questão 2
Letra d). Para a purificação do cloreto de sódio, separando-o de suas impurezas (por exemplo areia), devemos realizar as seguintes etapas:
1a etapa: inicialmente, deve-se adicionar água, já que apenas o cloreto de sódio dissolve-se (dissolução fracionada).
2a etapa: em seguida, devemos realizar uma filtração, para retirar os componentes sólidos que não foram dissolvidos na água.
3a etapa: por fim, realizar a destilação simples para separar o cloreto de sódio da água.
Resposta Questão 3
Letra a). Na situação I do esquema, ocorre uma dissolução do sal de cozinha presente na mistura inicial, porque, em seguida, está descrito que há uma solução aquosa mais o carvão, sendo essa solução uma mistura homogênea formada por um ou mais componentes dissolvidos. As outras alternativas estão incorretas porque:
b- ionização ocorre em compostos com característica iônica (ácidos, sais, bases, etc.), o que não é o caso do carvão.
c/d- liquefação é a passagem do vapor para o líquido.
e- sublimação é a passagem sólido para o gasoso.
Resposta Questão 4
Letra b). Ao adicionar água destilada na gasolina, o álcool que estava dissolvido na gasolina passa a dissolver-se na água por causa da polaridade e da capacidade de estabelecerem ligações de hidrogênio entre si.
A gasolina, por não se dissolver e por ser menos densa, formará uma fase superior.
Como apenas o álcool dissolve-se em água e a gasolina não, temos uma dissolução fracionada.
Para determinar o teor de álcool, basta observar que foram adicionados 50 mL de água na gasolina, e o volume de água subiu para 61 mL, logo, tínhamos 11 mL de etanol em 50 mL de gasolina. Por fim, basta utilizar esses valores na regra três abaixo:
50 mL de gasolina---------100%
11 mL de etanol-------------x
50.x = 11.100
50x = 1100
x = 1100
50
x = 22 %