Questão 1
(PUC-RS) Numa experiência, a reação de formação de amônia (NH3), a partir do N2 e do H2, está ocorrendo com um consumo de 12 mols de nitrogênio (N2) a cada 120 segundos. Nesse caso, a velocidade de consumo de hidrogênio (H2) é:
a) 6 mols por minuto
b) 12 mols por minuto.
c) 18 mols por minuto.
d) 24 mols por minuto.
e) 36 mols por minuto.
Questão 2
(UNIFICADO-RJ) Numa experiência envolvendo o processo:
N2 + 3H2 → 2NH3,
a velocidade da reação foi expressa como = 4,0 mol/L.h. Considerando-se a não ocorrência de reações secundárias, a expressão dessa mesma velocidade, em termos de concentração de H2, será:
a) -Δ[H2]/Δt = 1,5 mol/L.h
b) -Δ[H2]/Δt = 5,0 mol/L.h
c) - Δ[H2]/Δt= 6,0 mol/L.h
d) -Δ[H2]/Δt = 8,0 mol/L.h
e) -Δ[H2]/Δt = 12,0 mol/L.h
Questão 3
(PUC-RS) Amostras de magnésio foram colocadas em soluções aquosas de ácido clorídrico de diversas concentrações e temperaturas, havendo total consumo do metal e desprendimento do hidrogênio gasoso. Observaram-se os seguintes resultados:
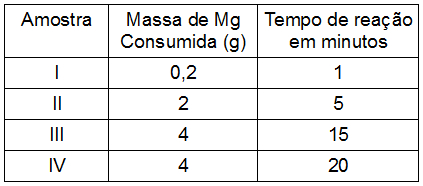
Pela análise dos dados contidos na tabela acima, é correto afirmar que:
a) a velocidade média da reação na amostra I é maior que na amostra II.
b) a quantidade de hidrogênio desprendida na amostra II é maior do que na amostra IV.
c) a velocidade média da reação na amostra III é igual à da amostra IV.
d) a velocidade média de reação na amostra IV é a metade da velocidade média de reação na amostra II.
e) a quantidade de hidrogênio desprendido na amostra III é menor do que na amostra IV.
Questão 4
Dada a equação abaixo:
X → Y + Z
A variação na concentração de X em função do tempo é proposta na tabela:
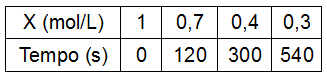
Qual será a velocidade média da reação no intervalo de 2 a 5 minutos?
a) 0,3 mol/L.min.
b) 0,1 mol/L.min.
c) 0,5 mol/L.min.
d) 1,0 mol/L.min.
e) 1,5 mol/L.min.
Questão 5
Abaixo temos a representação do processo de decomposição da amônia gasosa:
2 NH3 → N2 + 3 H2
A tabela abaixo indica a variação na concentração do reagente em função do tempo:

Qual será o valor da velocidade média de consumo do reagente nas três primeiras horas de reação?
a) 4,0 mol.L-1.h-1
b) 2,0 mol.L-1.h-1
c) 10 km.h-1
d) 1,0 mol.L-1.h-1
e) 2,3 mol.L-1.h-1
Questão 6
A velocidade média da reação 1 N2 + 3 H2 → 2 NH3 é 0,5 mols/min. A velocidade média em função do nitrogênio (N2) vale:
a) 6 mols / min.
b) 3 mols / min.
c) 2 mols / min.
d) 0,5 mols / min.
e) 5 mols / min
Resposta Questão 1
Letra c). A equação balanceada que represneta o processo descrito é:
N2 + 3H2 → 2NH3
Para determinar a velocidade do H2, é necessário antes calcular a velocidade do N2, já que o execício forneceu dados sobre ele. Dividindo o número de mols (12 mols) pelo tempo (2 minutos → 120 segundos), temos:
vN2 = 12
2
vN2 = 6 mols por minuto.
Por fim, basta multiplicar a velocidade do nitrogênio encontrada por 3, já que a proporção estequiométrica entre nitrogênio e hidrogênio na equação é de 1 para 3, ou seja, a velocidade do hidrogênio é o triplo da velocidade do nitrogênio.
vH2 = vN2.3
vH2 = 6.3
vH2 = 18 mols por minuto
Resposta Questão 2
Letra e). Como o exercício já forneceu a velocidade da reação, para determinar a velocidade de consumo do Hidrogênio (vH2), basta multiplicar a velocidade da reação (Vr) pelo coeficiente estequiométrico (3) do Hidrogênio na equação:
vH2 = Vr.3
vH2 = 4,0.3
vH2 = 12,0 mol/L.h
Resposta Questão 3
Letra d). Antes de avaliarmos as alternativas, como o exercício fala em velocidade média, devemos calculá-la para cada uma das amostras. Para isso, basta dividir a massa consumida pelo tempo:
Amostra 1: 0,2 = 0,2 g/min
1
Amostra 2: 2,0 = 0,4 g/min
5
Amostra 3: 4,0 = 0,26 g/min
15
Amostra 4: 4,0 = 0,2 g/min
20
Com as velocidades de cada amostra, agora podemos avaliar cada um dos itens:
-
Item a: errado porque a velocidade da amostra 1 é menor que a da amostra 2;
-
Item b: errado porque quanto maior é a massa do reagente, maior é a quantidade de produto formado;
-
Item c: errado porque as amostras 1 e 4 têm a mesma velocidade;
-
Item e: errado porque a quantidade de magnésio utilizada é a mesma; logo, a quantidade de hidrogênio desprendido será a mesma.
Resposta Questão 4
Letra b). Antes de determinar a velocidade da reação, é necessário determinar a variação da concentração e a variação do tempo entre 2 (que corresponde a 120 segundos) e 5 minutos (que corresponde a 300 s) utilizando os dados do participante X. Devemos sempre subtrair o final (=300 s) pelo inicial (120 s):
- Variação da concentração: será calculada em módulo porque o resultado final da velocidade não pode ser negativo.
Δ[] = |0,4-0,7|
Δ[] = |-0,3|
Δ[] = |0,3| mol.L-1
- Variação do tempo:
Δt = 5-2
Δt = 3 min
Por fim, basta utilizar os valores encontrados na fórmula da velocidade (variação da concentração dividida pela variação do tempo), já que nesse exercício a velocidade de consumo de X é igual à velocidade da reação, pois o coeficiente de X na equação é 1:
v = Δ[]
Δt
v = |0,3|
3
v = 0,1 mol/L.min
Resposta Questão 5
Letra e). Antes determinar a velocidade de consumo do NH3, é necessário determinar a variação da concentração e a variação do tempo entre as três primeiras horas. Lembrando que devemos sempre subtrair o final (terceira hora) pelo inicial (0 hora):
- Variação da concentração: será calculada em módulo porque o resultado final da velocidade não pode ser negativo.
Δ[] = |1-8|
Δ[] = |-7|
Δ[] = |7| mol.L-1
- Variação do tempo:
Δt = 3-0
Δt = 3 h
Por fim, basta utilizar os valores encontrados na fórmula da velocidade (variação da concentração dividida pela variação do tempo):
v = Δ[]
Δt
v = |7|
3
v = 2,33 mol.L-1.h-1
Resposta Questão 6
Letra d). Como o exercício já nos forneceu a velocidade da reação, para determinar a velocidade de consumo do nitrogênio (vN2), basta multiplicar a velocidade da reação (Vr) pelo coeficiente estequiométrico (1) do nitrogênio na equação:
vN2 = Vr.1
vN2 = 0,5.1
vN2 = 0,5 mols / min



