Questão 1
Veja a entalpia-padrão de formação, em KJ.mol-1 e a 25°C, de algumas substâncias:
CH4(g) -74,8
CHCl3(l) - 134,5
HCl(g) - 92,3
Se realizarmos a reação de cloração do metano, qual será o valor da variação da entalpia do processo?
CH4(g) + 3Cl2(g) → CHCl3(l) + 3HCl(g)
a) -115,9 KJ.mol-1
b) 186,3 KJ.mol-1
c) -376,2 KJ.mol-1
d) -336,6 KJ.mol-1
e) 148,5 KJ.mol-1
Questão 2
(UERJ) O alumínio é utilizado como redutor de óxidos, no processo denominado de aluminotermia, conforme mostra a equação química:
8 Al(s) + 3 Mn3O4(s) → 4 Al2O3(s) + 9Mn(s)
Observe a tabela:
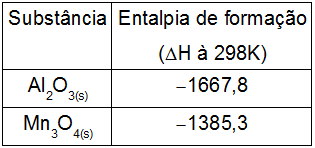
Segundo a equação acima, para a obtenção do Mn(s), a variação de entalpia, na temperatura de 298 K, em KJ, é de:
a) -282,5
b) -2515,3
c) -3053,1
d) -10827,1
Questão 3
(PUC-MG) O fenol (C6H5OH) é um composto utilizado industrialmente na produção de plásticos e corantes. Sabe-se que sua combustão total é representada pela equação:
C6H5OH(l) + 7O2(g) → 6CO2(g) + 3H2O(g)
ΔH= -3054KJ/mol
e que as entalpias de formação do CO2(g) e H2O(g) valem, respectivamente: –395kJ/mol e –286kJ/mol a 25ºC e 1 atm. A entalpia de formação do fenol, a 25ºC e a 1 atm, em kJ/mol, é igual a:
a) – 174,0
b) – 2373,0
c) + 174,0
d) + 2373,0
Questão 4
Calcule o valor da entalpia de combustão de um mol do benzeno (C6H6) sabendo que ele apresenta entalpia de formação no estado líquido igual a +49 kJ/mol, que o CO2 gasoso apresenta –394 kJ/mol e que o valor da água líquida é de –286 kJ/mol.
C6H6 + 15/2O2 → 6 CO2 + 3 H2O
a) +3 271.
b) –1 123.
c) +1 123.
d) –3 173.
e) –3 271.
Resposta Questão 1
Letra d). Veja o passo a passo para a determinação da variação de entalpia:
1o Passo: O cálculo da entalpia dos produtos (Hp) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados:
Hp = 1.HCHCl3(l) + 3. HHCl(g)
Hp = 1.(- 134,5) + 3(- 92,3)
Hp = - 134,5 + (-276,9)
HP = -411,4 KJ.mol-1
2o Passo: O cálculo da entalpia dos reagentes (Hr) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados:
OBS.: Como o Cl2(g) é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 1.HCH4(g) + 3. HCl2(g)
Hr = 1.(-74,8) + 3(0)
Hr = -74,8 KJ.mol-1
3o Passo: Cálculo da variação da entalpia do processo.
ΔH = Hp – Hr
ΔH= -411,4 - (-74,8)
ΔH= -336,6 KJ.mol-1
Resposta Questão 2
Letra b). Veja o passo a passo para a determinação da variação de entalpia:
1o Passo: O cálculo da entalpia dos produtos (Hp) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados.
Hp = 4.HAl2O3(s) + 9. HMn(s)
Hp = 4.(-1667,8) + 9.(0)
Hp = -6671,2 + 0
Hp = - 6671,2 KJ.mol-1
2o Passo: O cálculo da entalpia dos reagentes (Hr) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados.
OBS.: Como o Al(s)é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 8.HAl(s) + 3. HMn3O4(s)
Hr = 8.(0) + 3(-1385,3)
Hr = -4155,9 KJ.mol-1
3o Passo: Cálculo da variação da entalpia do processo.
ΔH = Hp – Hr
ΔH= - 6671,2 - (-4155)
ΔH= - 6671,2 - (-4155,9)
ΔH= -2515,3 KJ.mol-1
Resposta Questão 3
Letra a). Veja o passo a passo para a determinação da entalpia de formação do fenol.
1o Passo: Variação da entalpia: ΔH= -3054KJ/mol.
2o Passo: O cálculo da entalpia dos produtos (Hp) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados:
Hp = 6.HCO2(g) + 3.O2(g)
Hp = 6.(-395) + 3.(-286)
Hp = -2370 + (-858)
Hp = -2370 - 858
HP = - 3228 KJ.mol-1
3º Passo: O cálculo da entalpia dos reagentes (Hr) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados:
OBS.: Como o O2(g) é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 1.C6H5OH(l) + 3. HO2(g)
Hr = HC6H5OH(l) + 3(0)
Hr = HC6H5OH(l) KJ.mol-1
4º Passo: Cálculo da variação da entalpia do processo.
ΔH = Hp – Hr
-3054= - 3228 - (HC6H5OH(l))
HC6H5OH(l)= -3228 + 3054
HC6H5OH(l) -174 KJ.mol-1
Resposta Questão 4
Letra e).
1o Passo: O cálculo da entalpia dos produtos (Hp) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados.
Hp = 6.HCO2 + 3. HH2O
Hp = 6.(–394) + 3.(–286)
Hp = -2364 - 858
Hp = - 3222 KJ.mol-1
2o Passo: O cálculo da entalpia dos reagentes (Hr) é feito pela multiplicação do coeficiente de cada participante pela sua entalpia e, depois, pela soma dos resultados:
OBS.: Como o Oo2(g) é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 1.HC6H6 + 15/2. HO2
Hr = 1.(+49) + 15/2(0)
Hr = +49 KJ.mol-1
3o Passo: Cálculo da variação da entalpia do processo.
ΔH = Hp – Hr
ΔH= - 3222 - (+49)
ΔH= - 3222 - 49
ΔH= - 3271 KJ.mol-1



