Questão 1
(UFBA - adaptada) Dados:
.jpg)
(Fonte: BRADY & HUMISTON, p. 511.)
A tabela acima mostra as concentrações, em mol/L, do sistema em equilíbrio representado pela equação:
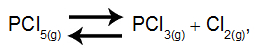
que foram obtidas, experimentalmente, a 297K. Calcule, com três algarismos significativos, o valor aproximado de Kp para essa reação. Expresse o resultado indicando 50% do valor de Kp.
a) 37
b) 47
c) 57
d) 67
e) 77
Questão 2
A pressão total de um sistema gasoso constituído por H2, I2 e HI e em equilíbrio é de 4 atm em uma dada temperatura. Sabendo que existem 40% de H2 e 10% de I2 e volume, qual é o valor da constante desse equilíbrio em termos de pressão?
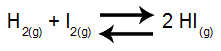
a) 62,5
b) 6,25
c) 625
d) 0,625
e) 0,0625
Questão 3
Em um recipiente fechado de 4 L de capacidade, encontram-se 7,2 g de H2O, 8 g de H2 e 6,4 g de O2 em equilíbrio e a 677oC. Qual dos valores propostos a seguir condiz com o valor da constante do equilíbrio em termos de pressão (Kp) desse sistema? Massas molares: H2O = 18g/mol; H2 = 2g/mol e O2 = 32g/mol.
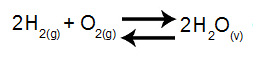
a) 2,5 atm-1
b) 0,00025 atm-1
c) 0,25 atm-1
d) 0,025 atm-1
e) 0,0025 atm-1
Resposta Questão 1
Letra d). Para calcular o Kp do processo, devemos fazer o seguinte:
1a etapa: determinar o valor da concentração de cada participante da reação.
Serão utilizados os valores da concentração do experimento 2 ou do experimento 3 porque a concentração do reagente PCl5 no primeiro é 0 e o valor do Kc utilizando os dados dos outros dois experimentos será o mesmo.
2a etapa: determinar o valor do Kc do processo a partir da utilização dos valores das concentrações de cada participante no equilíbrio 3.
Kc = [PCl3)4. [Cl2]1
[PCl5]1
Kc = 3,66 . 1,5
1
Kc = 5,49
1
Kc = 5,49 mol/L
3a etapa: determinar o valor do Kp do processo com a expressão a seguir.
Kp = Kc.(R.T)Δn
Obs.: o Δn é a variação do número de mol do produto (1 mol do PCl3 + 1 mol do Cl2) pelo número de mol do reagente (1 mol do Pcl5). R é a constante geral dos gases, cujo valor em atm é de 0,082.
Kp = 5,49.(0,082.298)2-1
Kp = 5,49.(24,436)1
Kp = 5,49.24,436
Kp = 134,15 atm
Retirando os 50% que o enunciado pede, ou seja, retirando a metade, temos, aproximadamente, 67 atm.
Resposta Questão 2
Letra b). Os dados fornecidos pelo exercício foram:
• Pressão total = 4 atm
• Porcentagem em volume do H2 = 40% ou 0,4
• Porcentagem em volume do I2 = 10% ou 0,1
Obs.: Como são apenas três gases no sistema e a somatória da porcentagem de dois deles é 50%, podemos afirmar que a porcentagem em volume do HI também é 50% por ser o que falta para 100%.
Para determinar o valor do Kp do sistema, devemos realizar os seguintes passos:
1a etapa: determinar os valores das pressões parciais de cada gás multiplicando a pressão total pela porcentagem.
• Para o H2:
pH2 = 4.0,4
pH2 = 1,6 atm
• Para o I2:
pI2 = 4.0,1
pI2 = 0,4 atm
• Para o HI:
pHI = 4.0,5
pHI = 2,0 atm
2a etapa: determinar o valor do Kp.
Kp = (pHI)2
(pH2)1.(pI2)1
Kp = (2)2
(1,6)1.(0,4)1
Kp = 4
1,6.0,4
Kp = 4
0,64
Kp = 6,25
Resposta Questão 3
Letra e). Os dados fornecidos pelo exercício foram:
• Temperatura: 677oC, que, em Kelvin (somando com 273), corresponde a 950 K
• Massa da água = 7,2 g
• Massa molar da água = 18g/mol
• Massa do H2 = 8 g
• Massa molar do H2 = 2g/mol
• Massa do O2 = 6,4 g
• Massa molar do O2 = 32g/mol
Para determinar o valor do Kp do sistema, devemos realizar os seguintes passos:
1a etapa: determinar o número em mol de cada gás dividindo a massa fornecida pela massa molar.
• Para o H2O = 7,2 = 0,4mol
18
• Para o H2 = 8 = 4mol
2
• Para o O2 = 6,4 = 0,2mol
32
2a etapa: determinar o valor da pressão de cada gás utilizando o valor do volume (4L), a constante geral dos gases (0,082) e a temperatura (950) na expressão de Clapeyron.
• Para o H2O
P.V = n.R.T
P.4 = 0,4.0,082.950
P.4 = 31,16
P = 31,16
4
p = 7,79 atm
• Para o H2
P.V = n.R.T
P.4 = 4.0,082.950
P.4 = 311,6
P = 311,6
4
p = 77,9 atm
• Para o O2
P.V = n.R.T
P.4 = 0,2.0,082.950
P.4 = 15,58
P = 15,58
4
p = 3,895 atm
3a etapa: determinar o valor do Kp.
Kp = (pH2O)2
(pH2)2.(pO2)1
Kp = (7,79)2
(77,9)2.(3,895)1
Kp = 60,684
6068,41.3,895
Kp = 60,684
23639,456
Kp = 0,0025 atm-1



