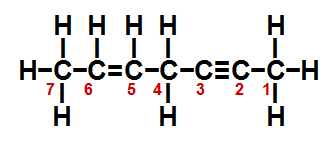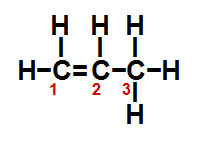Questão 1
(UFV-MG) No hidrocarboneto de fórmula estrutural representada abaixo, os átomos de carbono estão numerados de 1 a 7.
Sobre esse hidrocarboneto, são feitas as seguintes afirmativas:
I. O total de ligações π (pi) na estrutura é igual a 3.
II. O átomo de carbono 2 forma 3 ligações π (pi) e 1 ligação σ (sigma).
III. O átomo de carbono 5 forma 3 ligações σ (sigma) e 1 ligação π (pi).
IV. O átomo de carbono 1 forma 4 ligações σ (sigma).
São corretas apenas as afirmativas:
a) I, III e IV.
b) II e IV.
c) I e II.
d) I, II e IV.
Questão 2
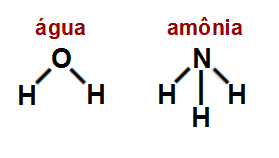
Dadas as fórmulas estruturais da água e da amônia a seguir:
Indique qual alternativa apresenta o tipo de ligação sigma comum a elas.
a) p-p
b) s-s
c) s-p
d) s-sp2
e) s-sp3
Questão 3
(ITA-SP) Em relação à molécula esquematizada abaixo, são feitas as seguintes afirmações:
I. Entre os átomos de carbono 1 e 2 existe uma ligação sigma.
II. Entre os átomos de carbono 1 e 2 existe uma ligação pi.
III. Entre os átomos de carbono 1 e 2 existem duas ligações sigma.
IV. Entre os átomos de carbono 1 e 2 existem duas ligações pi.
V. Todas as ligações entre os átomos de carbono e hidrogênio são ligações sigma.
Entre as afirmações feitas, estão corretas apenas:
a) I e II.
b) I e III.
c) I, II e V.
d) I, III e V.
e) II, IV e V.
Questão 4
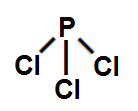
Ligação sigma é o nome dado à interpenetração (junção) de dois orbitais (regiões com maior probabilidade de um elétron ser encontrado) atômicos incompletos no mesmo eixo. Por tratar-se de uma ligação covalente, ela não ocorre entre metais, ou seja, ocorre apenas entre o elemento hidrogênio e ametais. Baseando-se nesses conhecimentos, e no tipo de orbital atômico incompleto de cada átomo, em qual das moléculas a seguir temos uma ligação sigma do tipo p-p?
a) PCl3
b) H2S
c) O2
d) HI
e) NDA.
Resposta Questão 1
Letra a). A alternativa correta é a letra a porque:
I- Verdadeira. A ligação pi está presente apenas em ligações dupla e tripla. Como na estrutura temos uma ligação dupla (que apresenta 1 ligação pi) e uma ligação tripla (que apresenta duas ligações pi), logo, ela possui 3 ligações duplas.
II- Falsa. No carbono 2, temos uma ligação tripla (a qual é formada por 2 pi e 1 sigma) e uma simples (ligação sigma). Assim, temos 2 ligações pi e 2 ligações sigma.
III- Verdadeira. No carbono 5, temos uma ligação dupla (a qual é formada por 1 pi e 1 sigma) e duas ligações simples (que são ligações sigma). Assim, temos 3 ligações sigma e 1 ligação pi.
IV- Verdadeira. O carbono 1 possui quatro ligações simples (que são ligações sigma).
Resposta Questão 2
Letra c). Em ambas moléculas, temos apenas a presença de ligações sigma do tipo s-p porque:
Todas as sigma envolvem o elemento hidrogênio, cujo orbital atômico incompleto é o s;
Na água, o hidrogênio está ligado ao oxigênio, e, na amônia, ele está ligado ao nitrogênio. Esses dois elementos apresentam o orbital atômico p incompleto.
Obs.: Nas alternativas d e e aparece a referência aos orbitais sp2 e sp3, os quais têm relação com o elemento carbono ou com os elementos berílio e boro, respectivamente.
Resposta Questão 3
Letra c). A resposta é a alternativa c, porque:
I- Verdadeiro, pois, como é uma dupla, uma ligação é sigma e a outra é pi.
II- Verdadeiro, pois, como é uma dupla, uma ligação é sigma e a outra é pi.
III- Falso, pois, como é uma dupla, uma ligação é sigma e a outra é pi.
IV- Falso, pois, como é uma dupla, uma ligação é sigma e a outra é pi.
V- Verdadeiro, pois todas as ligações entre os átomos de carbono e hidrogênio são simples.
Resposta Questão 4
Letra c). A melhor forma de determinar o tipo de uma ligação sigma é conhecendo inicialmente os orbitais incompletos dos átomos envolvidos e, em seguida, montar sua fórmula estrutural:
- Átomos envolvidos
Hidrogênio = possui o orbital s incompleto;
Fósforo (P), Oxigênio (O), Cloro (Cl), Iodo (I) = possuem o orbital p incompleto.
Com isso, as alternativas b e d são excluídas, pois a pergunta envolve sigma p-p e, se o hidrogênio está envolvido, ela não será desse tipo.
- Montando a fórmula estrutural
a- No PCl3, o fósforo realiza 3 ligações sigma com os átomos de cloro, logo, temos 3 ligações sigma p-p.
c- No O2, temos uma ligação dupla entre os átomos, a qual é composta por uma ligação sigma e outra pi. Como os átomos são iguais, a ligação sigma é do tipo p-p.