Questão 1
(ITA-SP) Em qual dos pares de substâncias puras abaixo, ambas no estado sólido, são encontradas em cada um delas, simultaneamente, ligações covalentes e ligações de Van der Waals?
a) Iodo e dióxido de carbono.
b) Dióxido de silício e naftaleno.
c) Iodo e óxido de magnésio.
d) Magnésio e dióxido de carbono.
e) Cloreto de amônio e sulfato de chumbo.
Questão 2
(UFAC) Dentre os gases dissolvidos na água, o oxigênio é um dos mais importantes indicadores da qualidade de água. O oxigênio é fundamental à sobrevivência dos organismos aquáticos. Além dos peixes, as bactérias aeróbicas consomem o oxigênio dissolvido para oxidar matéria orgânica (biodegradável). A disponibilidade do oxigênio, em meio aquático, é baixa em virtude da sua limitada solubilidade em água devido às fracas interações intermoleculares entre as moléculas do gás (apolares) e as moléculas de água (polares). O lançamento de esgotos domésticos e efluentes industriais, ricos em matéria orgânica, nos corpos d’água, ocasiona uma maior taxa de respiração de micro-organismos, causando uma substancial redução do oxigênio dissolvido. As interações intermoleculares, existentes entre a água e o gás oxigênio nela dissolvido, são do tipo:
a) ligações de hidrogênio.
b) dipolo induzido.
c) covalentes.
d) dipolo dipolo.
e) iônica.
Questão 3
Uma lagartixa consegue andar sobre uma superfície lisa como o vidro ou o teto de uma casa sem cair porque entre suas patas e a superfície ocorrem interações intermoleculares do tipo:
a) dipolo dipolo.
b) ligações de hidrogênio.
c) forças de London.
d) iônica.
e) covalente.
Questão 4
Dadas as fórmulas das substâncias abaixo e os números atômicos dos elementos químicos que as compõem, marque a alternativa que apresenta a única ou o par de moléculas que apresenta forças intermoleculares do tipo dipolo induzido ou forças de Van der Waals.
O3, CO2 e H3CCl
Dados: números atômicos dos elementos: C = 6, O = 8 e Cl = 17
a) CO2.
b) O3.
c) H3CCl.
d) O3 e CO2.
e) O3 e H3CCl.
Resposta Questão 1
Letra b). O dióxido de silício (SiO2) apresenta ligações covalente porque é formado exclusivamente por elementos ametais. O naftaleno (C10H8), por ser um hidrocarboneto, é um composto apolar e, por isso, suas moléculas interagem por ligações de Van der Waals.
Letra a): Está incorreta porque traz apenas o nome do elemento iodo, ou seja, como aparece de forma isolada, não há como ele estabelecer uma ligação covalente.
Letra c): Está incorreta porque o óxido de magnésio é um composto iônico, logo, apresenta ligações dipolo permanente.
Letra d): Está incorreta porque o magnésio, por ser um metal, apresenta entre seus átomos ligações metálicas.
Letra e): Está incorreta porque o sulfato de chumbo é um composto iônico, logo, apresenta ligações dipolo permanente.
Resposta Questão 2
Letra b). A molécula de água (H2O) é polar (por apresentar vetor momento dipolar diferente de zero, já que apresenta quatro nuvens eletrônicas e dois ligantes iguais), e a molécula do gás oxigênio (O2) é apolar (apresenta átomos de mesma eletronegatividade ligados entre si). A força intermolecular que une moléculas com essa característica é dipolo induzido.
Resposta Questão 3
Letra c). A lagartixa apresenta nas pontas de suas patas cerdas cujas moléculas são apolares e que interagem com os componentes apolares do vidro e da parede.
Resposta Questão 4
Letra a). A força intermolecular dipolo induzido é característica de substâncias de caráter apolar, como o CO2.
O3 (Ozônio): é polar porque possui três nuvens eletrônicas (ligação dupla, ligação dativa e um par de elétrons não ligantes) no átomo central (oxigênio) e apenas dois ligantes iguais ligados a ele.
.jpg)
CO2 (dióxido de carbono): é apolar porque a molécula apresenta duas nuvens (duas ligações duplas) no átomo central (carbono) e dois ligantes (átomos de oxigênio) iguais ligados a ele, como podemos observar nas fórmulas eletrônica e estrutural abaixo:
.jpg)
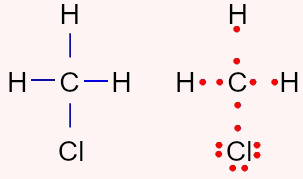
H3CCl (Clorometano): é polar porque possui quatro nuvens (ligações simples) no átomo central e apenas três ligantes iguais (átomos de hidrogênio) ligados a ele.